L’usage répandu des antibiotiques et leur mauvais usage fréquent dans tous les pays ont entraîné l’émergence de la résistance aux antibiotiques, avec des « superbactéries » résistantes à la plupart, voire à l’ensemble des antibiotiques. Outre un arsenal limité d’antibiotiques efficaces et disponibles, peu de nouveaux antibiotiques sont en cours de développement. Il est donc essentiel d’optimiser l’utilisation des antibiotiques qui sont encore efficaces. Ceci est particulièrement vrai dans le cas des infections sévères et d’infections à bactéries multirésistantes, qui sont plus difficiles à traiter.
En conséquence, la manière dont les infections sont prévenues et traitées doit être améliorée en :
- Utilisant des antibiotiques uniquement lorsqu’il existe une indication bien réelle
- Optimisant la posologie et la voie d’administration des antibiotiques ce qui permet aux patients d’être guéris plus vite et de ralentir le taux de résistance émergente
- Procédant à une surveillance continue des profils de sensibilité aux antibiotiques et des Concentrations Minimales Inhibitrices (CMI) par le laboratoire de microbiologie afin d’orienter le choix des traitements empiriques de manière fiable.
L’intérêt de déterminer la concentration minimale inhibitrice (CMI) dans la personnalisation du traitement antibiotique, en particulier pour le traitement des patients critiques et des bactéries résistantes aux antibiotiques est un élément essentiel de la prescription et de plus en plus reconnu.
Quelle est l’utilité de la CMI ?
La CMI constitue un élément essentiel de la relation entre un antibiotique et des micro-organismes. Elle se définit comme la plus petite concentration d’un antibiotique permettant d’inhiber une bactérie / un champignon et permet de mesurer la sensibilité de l’agent pathogène à un antibiotique. Les CMI sont utilisées pour mesurer la sensibilité d’un agent pathogène à un éventuel traitement antibiotique in vitro :
- Une CMI faible indique une plus grande sensibilité à l’antibiotique
- Une CMI élevée indique une sensibilité plus faible et un risque de résistance vis-à-vis de l’antibiotique
Cependant, l’interprétation de la valeur de la CMI dépend de l’antibiotique et de l’agent pathogène (par exemple dans le traitement d’une infection du liquide céphalorachidien, une CMI faible pour Streptococcus pneumoniae et la Ceftriaxone peut encore être considérée comme indiquant une résistance en raison d’une diminution possible de la pénétration antibiotique de la barrière cérébrale)
L’antibiogramme et la mesure de la CMI ont pour but de prévoir la probabilité de succès ou d’échec du traitement prescrit.
Découvrez le VITEK REVEAL avec son antibiogramme rapide avec CMI !
Quelle est l’importance de la CMI pour guider le clinicien dans sa prescription?
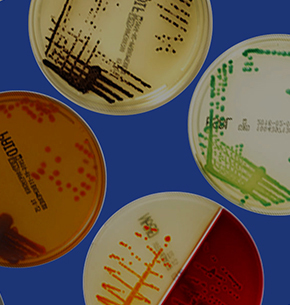
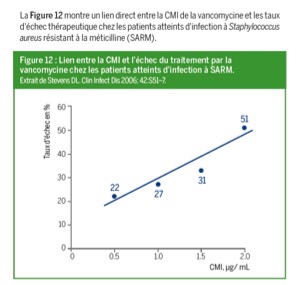
- De choisir l’antibiotique le plus adapté : de nombreuses études ont démontré un lien direct entre la CMI et le résultat chez le patient (figure 12)
- D’adapter la posologie antibiotique en tenant compte de la sensibilité de l’agent pathogène (CMI) associé au profil du patient et aux paramètres pharmacocinétiques de l’antibiotique
Qu’est-ce que le seuil de sensibilité clinique de la CMI ?
Il s’agit de la concentration d’un antibiotique qui définit si une espèce bactérienne est sensible ou résistante à un antibiotique donné. Les seuils de sensibilité clinique font référence aux CMI qui séparent les souches pour lesquels la probabilité de succès thérapeutique est forte de celles pour lesquelles il existe une forte probabilité d’échec thérapeutique
- Le phénotype de résistance « sauvage » ou intrinsèque (ou résistance innée ou naturelle) indique que l’espèce bactérienne n’abrite aucun mécanisme de résistance aux antibiotiques qui soit par acquisition ou par mutation.
- Les isolats « non sauvages » possèdent une résistance acquise, et donc
une sensibilité moindre aux agents antimicrobiens.
Le seuil épidémiologique (ECOFF) permet de distinguer deux populations et de les classer en catégorie « sauvage » ou « non sauvage », en fonction des valeurs des CMI.
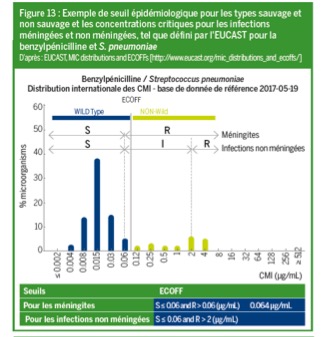
Chez les patients dont la pharmacocinétique change considérablement, les seuils critiques S, I et R peuvent ne pas toujours être adaptés et il est indispensable de connaître la CMI pour optimiser le choix et la posologie de l’antibiotique (figure 13).
L’importance de la CMI pour le choix de l’antibiotique ?
La CMI facilite le choix de l’antibiotique, associé à la connaissance du contexte clinique, de la durée d’exposition et la posologie des différents antibiotiques
- Si la CMI est faible (inférieur au seuil de sensibilité), il y a de fortes chances qu’un antibiotique soit efficace et qu’il constitue donc un choix thérapeutique adapté
- Si la CMI est élevée (supérieure au seuil de sensibilité, c’est-à-dire intermédiaire ou résistante), l’effet thérapeutique d’un antimicrobien peut être limité ou nul
…….;
Un livret dédié sera bientôt disponible et reprendra de façon détaillé 2 points essentiels
- L’intérêt de déterminer la CMI dans la personnalisation du traitement antibiotique
- Les principes d’optimisation de la prescription et de la posologie antibiotique pour traiter les infections bactériennes