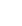Cet article a été rédigé sans conflit d’intérêt, dans le but de servir exclusivement à des fins éducatives. Les informations présentées visent à enrichir la compréhension des lecteurs sans promouvoir une quelconque entité ou produit. Ce document étant éducationnel, il est volontairement incomplet et peut contenir des approximations, erreurs ou anachronismes. En outre, les documents disponibles sur le site du Ministère de la Santé et de l’Assurance Maladie font références. Pour toutes informations ou modifications, merci de contacter Magali Marmiesse : magali.marmiesse@biomerieux.com.
Le rôle du diagnostic in vitro et de la biologie sont essentiels pour les patients : 70 % des décisions médicales reposent sur les résultats1 qu’ils apportent. Ainsi, leurs financements en France représentent un enjeu majeur.
Avec 11,9% du Produit intérieur brut (PIB) consacrés aux dépenses de santé en 20222, la France se positionne en troisième place mondiale derrière l’Allemagne, dont les dépenses représentent 12,6% du PIB. Le pays consacrant la plus grande part du PIB aux dépenses de santé sont les Etats-Unis, avec 18,2% du PIB, contre 11,3% au Royaume Uni et 9,8% en Italie.
Si l’on analyse le chiffre d’affaires du secteur des industries de la santé généré en France en 2021, il est intéressant de voir que le chiffre d’affaires généré par le secteur du diagnostic in vitro ne représente que 2,71% du total du secteur.

Le système de financement de la santé en France
Le système de financement de la santé en France repose sur deux piliers majeurs :
- L’Objectif National des Dépenses d’Assurance Maladie (ONDAM) : c’est une enveloppe annuelle votée par le Parlement, gérée par l’Assurance Maladie. Elle est allouée aux 17 Agences Régionales de Santé (ARS) en France afin d’apporter des enveloppes permettant de financer une partie du fonctionnement des établissements de santé publics et privés. L’ONDAM intègre toutes les dépenses T2A et enveloppes annexes, telles que les MIGAC et MERRI.
- La Tarification à l’Activité (T2A) : c’est un mécanisme de tarification s’appuyant sur le codage des activités médicales. Elle est le socle du financement des établissements de santé publics et privés.
Différentes modalités de financement liées à la tarification à l’activité existent :
- Le tarif par séjour ou Groupe Homogène de Séjour (GHS) : c’est un tarif qui couvre l’ensemble des coûts liés à la prise en charge globale du patient.
- La prestation d’hospitalisation en SUS : elle permet la prise en charge de certains médicaments coûteux et de certains dispositifs médicaux implantables.
- La facturation des prestations ambulatoires et des consultations externes : dans cette modalité de financement, un acte de biologie médicale sera facturé selon une nomenclature.
- Le forfait urgence : il correspond à la prise en charge des frais engendrés par un passage aux Urgences.
Il est important de garder à l’esprit les particularités de financement de la biologie entre les établissements privés et publics.
Le financement de la biologie médicale dans le public et le privé
En introduction, rappelons qu’un examen de biologie médicale est défini par 3 phases3 :
- La phase pré-analytique : le prélèvement de l’échantillon biologique, le recueil des éléments cliniques, le transport…
- La phase analytique : réalisation de la phase analytique de l’examen.
- La phase post-analytique : la validation, l’interprétation et la communication du résultat.

Le financement de la biologie comprend le personnel, les investissements, les charges de structure et le test.

Le test de diagnostic in vitro ne représente qu’une part de l’examen de biologie médicale.
Le financement de la biologie médicale diffère entre le secteur public et privé. Dans le secteur public, la biologie est intégrée dans le tarif par séjour (GHS). En revanche, dans le secteur privé, le tarif par séjour n’inclut pas la biologie médicale. Les actes de biologie sont facturés par la Nomenclature des Actes de Biologie Médicale (NABM).
Le montant du tarif par séjour dépendra donc de deux critères :
- La typologie de l’établissement de santé : public ou privé
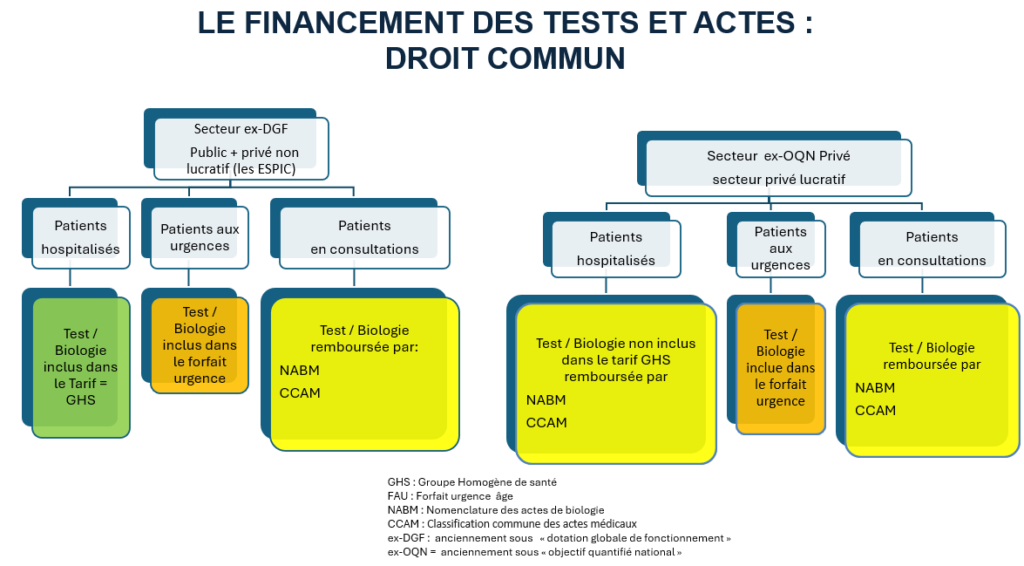
- La sévérité de la pathologie en question : elle est déclinée en 4 niveaux graduels, le niveau 4 étant le plus grave.
Par exemple, le tarif GHS en 2023 pour un patient de 20 ans hospitalisé pour une pneumonie et pleurésie banales s’élèvera à 7 522,48€ s’il est pris en charge dans un hôpital public pour un niveau de sévérité 4. En cas de prise en charge dans une clinique privée avec le même niveau de sévérité et la même pathologie, le tarif GHS s’élèvera à 3 407,30€4.
La NABM est un système de codage spécifique utilisant la lettre clé B pour identifier et financer les actes de biologie médicale. Cependant, dans le secteur public, cette lettre clé est principalement un outil de suivi d’activité du laboratoire et ne contribue pas directement au financement des actes pour les patients hospitalisés.
Les mécanismes de financement de l’innovation diagnostic en biologie médicale
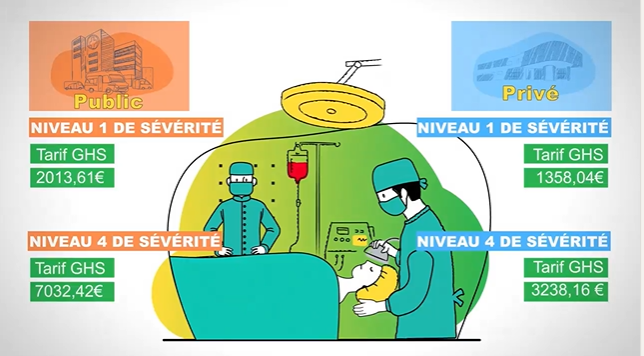
Il existe plusieurs piliers pour financer l’innovation diagnostic en biologie médicale. Nous retrouvons le Référentiel des Actes Innovant hors Nomenclature (RIHN), le forfait innovation et l’article 51.
- Le forfait innovation : il est définit par la Haute Autorité de Santé comme « un dispositif de prise en charge dérogatoire et temporaire pour faciliter l’accès précoce des patients à des technologies innovantes en phase précoce de développement clinique »5.
- L’article 51 : c’est un dispositif permettant l’expérimentation de nouvelles organisations en santé afin d’améliorer le parcours de soins du patient6.
- Le RIHN : c’est un « dispositif de soutien à la biologie médicale et à l’anatomopathologie innovantes. Ce « pilier de soutien à l’innovation » permet une prise en charge précoce et transitoire d’actes innovants de biologie médicale et d’anatomopathologie »7.
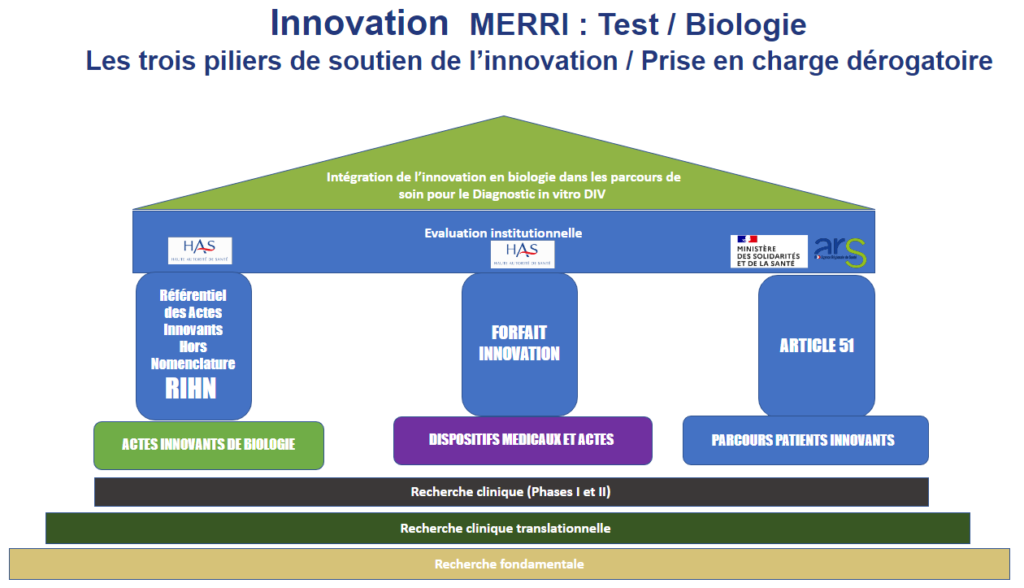
Le référentiel des actes innovants hors nomenclature (RIHN), mis en place par la direction générale de l’offre de soins (DGOS) dans le cadre du développement de l’innovation en santé est un dispositif de soutien à la biologie médicale et à l’anatomopathologie innovantes. Il permet la prise en charge précoce et transitoire d’actes innovants.
Il a été mis en place en 2015, succédant au référentiel de Montpellier.
Focus sur le RIHN
C’est un financement dérogatoire d’actes innovants conditionné à la réalisation d’un recueil de données avant leur prise en charge en droit commun (inscription aux nomenclatures NABM pour la biologie et CCAM pour l’anatomopathologie).
L’instruction DGOS/PF4/DSS/1A/2018/101 du 16 avril 2018 relative aux actes de biologie médicale et d’anatomopathologie hors nomenclatures détaille les règles de facturation de ces actes et les modalités de délégation associées :
« Cette instruction prévoit le financement du RIHN au titre de la mission d’intérêt général d’enseignement, de recherche, de rôle de référence et d’innovation (MERRI) G038 . Elle précise la règle applicable dans le cas où l’acte RIHN est prescrit et réalisé dans des établissements de santé distincts. Dans ce cas de figure, l’établissement effecteur peut facturer l’acte à l’établissement prescripteur. L’établissement prescripteur peut demander un financement de cette activité au titre de la MERRI G03. »9
L’enveloppe dédiée au RIHN est une enveloppe fermée dont le montant en 2024 s’élève à 521,5 millions d’euros10. Les dépenses de santé sont en constantes augmentations. De plus en plus d’innovations arrivant sur le marché, le besoin de prise en charge de ces tests augmente chaque année. Depuis 2015, la somme perçue annuellement par les établissements ne correspond pas à la somme déclarée. Ils perçoivent 50% en moyenne de la somme de l’activité déclarée, parfois moins.
Il existe également la liste complémentaire d’actes, indépendante au RIHN également pris en charge au titre de la dotation MERRI11 (Mission d’intérêt général d’enseignement, de recherche, de rôle de référence et d’innovation) . Elle comprend un stock d’actes en attente d’évaluation par la HAS et dont le financement à vocation à basculer dans le droit commun ville/hôpital en attente d’évaluation positive.
La réforme du RIHN 1.012
Depuis 2021, la DGOS pilote une réforme pour redynamiser le RIHN et le recentrer sur l’innovation.
Pourquoi réformer le RIHN ?
Lors de sa mise en place en 2015, le RIHN devait permettre le développement de recueil de données en vue des évaluations par la HAS.
L’objectif poursuivi était en effet la démonstration de l’efficacité clinique et de l’utilité clinique et/ou médico-économique de ces actes afin de permettre leur évaluation par la HAS, en vue d’une prise en charge par la collectivité (droit commun). Toutefois, depuis 2015, très peu de recueils de données ont été mis en œuvre. Aussi, un nombre limité d’actes de biologie médicale et d’anatomopathologie a pu sortir de cette liste et être pris en charge en droit commun. Un stock s’est donc constitué, composé d’actes initialement innovants, mais désormais utilisés en soins courants.
Afin de renouer avec l’objectif initial du dispositif, le président de la république a ainsi annoncé en juin 2021, dans le cadre de la présentation de la stratégie innovation santé 2030, une réforme du RIHN pour garantir un soutien dynamique à l’innovation.
La réforme comporte 4 grands objectifs :
- Dynamiser et encadrer les procédures d’inscription et de la radiation du RIHN, en impliquant la HAS dans le processus d’évaluation des actes
- Accroître le recueil de données en vie réelle pour permettre une évaluation rapide des actes et leur sortie du RIHN
- Accélérer la tarification et la procédure de remboursement par l’assurance maladie dans le droit commun
- Ouvrir le dépôt des actes à de nouveaux acteurs comme les fabricants ou les distributeurs de dispositifs médicaux.
Sur quoi portent les travaux de la réforme ?
La DGOS a entrepris une démarche globale afin de redynamiser le RIHN autour de 4 axes :
- Dépoussiérer la liste avec une enquête sur les actes peu prescrits menées auprès des CNPs (Conseil Nationaux Professionnels) et des filières maladies rares (avec une suppression de 31 actes obsolètes). L’enquête menée auprès des CNPs et FSMR (Filière de Santé des Maladies Rares) concernait les actes prescrits en moyenne 150 fois par an sur 2017, 2028 et 2019 (64 actes du RIHN et 83 actes de la Liste Complémentaire).
- Débloquer le financement avec la saisine de la HAS réalisée en octobre 2021 pour évaluer les actes onéreux en vue de leur sortie du RIHN. Quatorze actes ont été classés comme les plus onéreux, dont 11 RIHN et 3 de la Liste complémentaires qui sont en cours d’ évaluations (voir schéma ci-dessous).
- Revenir aux fondamentaux (c’est-à-dire financer l’innovation) avec les travaux, en lien avec la HAS et la CNAM, sur la sortie des actes du stock qui sont utilisés en routine.
- Créer un nouveau guichet de financement, le RIHN2.0.
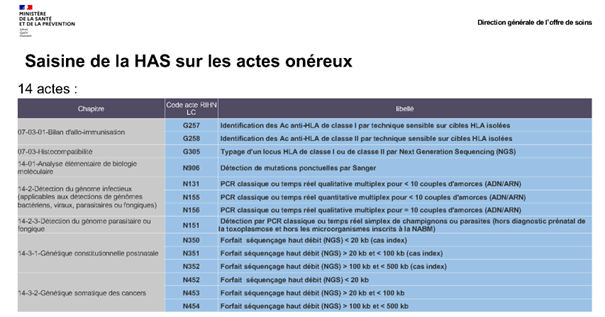
Le calendrier des évaluations est le suivant et disponible sur le site de la HAS.
Oncologie

Infectiologie
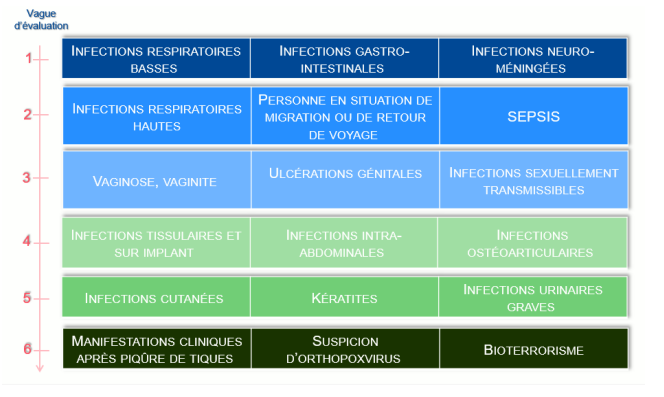
Les enjeux de bascule des actes du RIHN vers le droit commun
En sortie du RIHN, la prise en charge des actes de biologie médicale innovant passera par la NABM pour les établissements de santé privés et les patients en consultations externes à l’hôpital, mais elle reste à définir pour les patients hospitalisés en établissements de santé publics.
Solutions et perspectives
Plusieurs solutions ont été envisagées par l’écosystème pour faire évoluer le financement de la biologie médicale en sortie de RIHN dans le secteur hospitalier , telles que :
- La revalorisation des tarifs GHS.
- La création d’une enveloppe dédiée au financement de la biologie innovante/complexe pour les patients hospitalisés, en sus de la dotation MERRI G03.
- La création des suppléments facturés en SUS du tarif GHS.
- L’extension de la NABM au secteur hospitalier.
- La revalorisation des forfaits tels que ceux de l’urgence sont également à définir.
Découvrez une vidéo pour bien comprendre le fonctionnement de la biologie médicale et de l’innovation :
Les enjeux de dispositions transitoires sur le stock d’actes RIHN 1.0
En juillet 2024, les listes 2023 des Actes Hors Nomenclature (AHN) c’est-à-dire du référentiel innovant des actes hors nomenclatures et de la liste complémentaire ont été fusionnées.
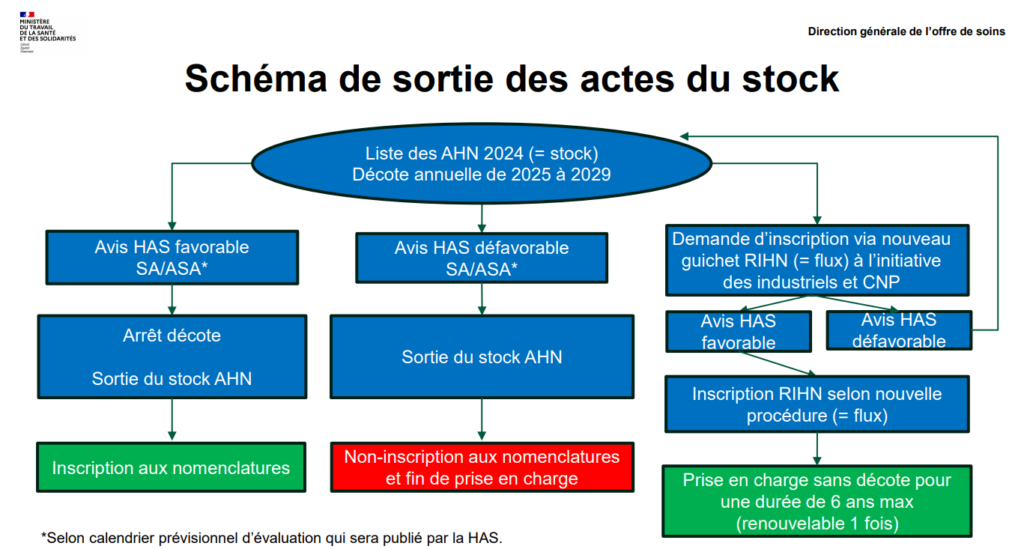
Ces Actes Hors Nomenclatures financés à titre provisoire par la dotation MERRI (pour la plupart depuis 2009) feront l’objet d’une décote annuelle de 20 % de la valeur des actes à partir de 2025.
Les actes concernés sont ceux inscrits sur la liste des Actes Hors Nomenclatures pour 2024 (c’est-à-dire un stock de 616 actes issus des listes 2023 du RIHN et de la liste complémentaire).
Les actes innovants inscrits sur la liste des AHN pour 2024 (c’est-à-dire le stock) peuvent faire l’objet d’une demande de prise en charge selon la nouvelle procédure du RIHN. En cas d’avis favorable de la HAS, cela permettra une prise en charge de 6 années de financement supplémentaire sans décote (renouvelable 1 fois si données insuffisantes).
Les CNPs et exploitants de dispositifs médicaux de diagnostic in vitro, concernés par des actes innovants de la liste 2024 des AHN, sont invités à déposer une demande d’inscription selon la nouvelle procédure du RIHN (c’est ce qu’on appelle le flux)13.
Voici le schéma représentant les différents scénarii en sortie de stock :
Le nouveau RIHN 2.0
La révision du dispositif, le « RIHN 2.0 », est intégrée dans le code de la sécurité sociale par l’article 51 de la LFSS pour 2023 et précisée par le décret n° 2024-290 du 29 mars 2024 relatif aux conditions de prise en charge des actes innovants de biologie ou d’anatomopathologie hors nomenclatures14.
L’article 51 du PLFSS 202315 qui a introduit cette réforme du RIHN vise à fixer de nouvelles modalités du mécanisme et à rendre le recueil de la collecte de données cliniques et médico-économiques obligatoires.
Les actes de biologie ou d’anatomopathologie sont éligibles pour des indications pour lesquelles ils n’ont jamais fait l’objet de prise en charge ou de remboursement par l’Assurance Maladie. Par ailleurs, ils doivent présenter un caractère de nouveauté ne se limitant pas à une évolution technique des technologies de santé utilisées dans les indications considérées. Le détail des conditions d’éligibilité est fixé à l’article R. 162-122 du décret16.
La prise en charge des actes est subordonnée :
- A la réalisation d’un recueil de données, que le demandeur s’engage à organiser et financer.
- A l’information orale et écrite de chaque patient.
Les travaux de réforme du RIHN ont été menés par la DGOS en lien avec toutes les parties prenantes : professionnels de santé, industriels, pouvoirs publics.
Le RIHN 2.0 est précisé par un arrêté qui établit le modèle du dossier de demande d’inscription et la liste des éléments justificatifs associée.
La publication de l’arrêté est disponible sur Légifrance, le guichet de financement du RIHN2.0 est ouvert.
Quels sont les critères pour candidater au RIHN 2.0 ?
Pour être éligible et financé par le RIHN 2.0, le dossier de demande d’inscription doit :
- Concerner un acte de biologie ou d’anatomopathologie innovant ou un test compagnon d’un médicament qui dispose d’une autorisation d’accès précoce.
- Présenter les modalités de réalisation d’un recueil de données cliniques ou médico-économiques.
- Être déposé par un conseil national professionnel (CNP) ou par l’exploitant d’un dispositif médical de diagnostic in vitro (DMDIV).
Quelle sera la procédure pour le RIHN 2.0 ?
Nouvelle procédure d’inscription d’un acte au RIHN 2.0 :
- Dépôt du dossier auprès de la Haute Autorité de Santé (HAS) sur la plateforme EVActe + envoi du dossier au ministère du travail, de la santé et des solidarités (MTSS).
- Phase de recevabilité du dossier réalisée par la HAS sous 15 jours.
- Phase d’évaluation réalisée par la HAS :
▪ Cas 1 : sans demande complémentaire, avis HAS sous 75 jours.
▪ Cas 2 : si demande complémentaire de la HAS, le demandeur a 60 jours pour transmettre les compléments et la HAS a 15 jours de plus pour rendre son avis, soit 75 + 60 + 15 = 150 jours au maximum. - Phase de tarification et décision de prise en charge par le Ministère du Travail de la Santé et des Solidarités (MTSS) sous 60 jours.
▪ La décision comprend pour l’acte : valeur, indication, durée de prise en charge et centres autorisés. - La durée de prise en charge démarre à la date d’admission du premier patient (pour 6 ans maximum).
Procédure en sortie du RIHN 2.0 :
- Si les données générées sont suffisantes : 6 mois avant la fin de la prise en charge, le demandeur transmet les données recueillies au MTSS, la HAS et l’ Union Nationale des Caisses d’Assurance Maladie (UNCAM).
- Si les données générées sont insuffisantes :
▪ Cas 1 : la HAS peut proposer une prolongation de la prise en charge. Le MTSS valide ou non, sous 30 jours.
▪ Cas 2 : 9 mois avant la fin de la prise en charge, le demandeur peut solliciter une prolongation de la prise en charge. Le MTSS valide ou non, sous 3 mois.
▪ Dans les 2 cas : cette prolongation ne peut excéder la durée de la période précédente (6 ans max). - Evaluation du Service Attendu (SA) et de l’Amélioration du Service Attendu (l’ASA) par la HAS sous 6 mois.
- Si un avis favorable de la HAS est donné : prolongation de 6 mois de la prise en charge au RIHN et l’UNCAM procède à l’inscription aux nomenclatures pendant cette période17.
Objectif prioritaire du référentiel des actes innovants hors nomenclature : financer des actes présentant une réelle innovation dans la prise en charge des patients en biologie médicale et anatomopathologie.
Pour le recentrer sur cette priorité, la DGOS et la Haute Autorité de Santé l’ont fait évoluer, en se basant sur un nouveau mode de sélection des projets et de financement par l’Assurance Maladie.
Vous voulez en savoir plus sur le « RIHN 2.0 » et la nouvelle procédure d’inscription des actes, consulter le site du Ministère de la Santé et regarder la vidéo jointe :
Les enjeux de la réforme du RIHN 2.0
- Aujourd’hui, seuls les CNPs ou les industriels peuvent déposer une demande d’évaluation d’actes RIHN. En effet, il n’est pas possible aux établissements de santé de déposer des dossiers RIHN 2.0.
- Le recueil de données (cliniques et/ou médico-économiques) entraîne une charge de travail conséquente, dont le financement est à la charge intégrale des demandeurs.
- A ce jour, les CNPs ne sont pas encore familiers aux procédures de dépôt des dossiers RIHN 2.0, nouvelle mission pour laquelle ils ne sont pas financés. Il serait important que les CNPs soient formés et financés.
- Dans le nouveau RIHN 2.0, le demandeur sera impliqué dans la fixation et la tarification de la « proposition de valorisation unitaire maximale » qui est un challenge en raison de la nécessité de l’appui de la comptabilité analytique des établissements de santé réalisant les actes.
- Malgré les efforts considérables menés par HAS pour évaluer de nombreux actes, le nombre d’actes restant à évaluer dans des délais très courts est très conséquent, cela va représenter un challenge pour la HAS. A noter la HAS a traité environ 15 dossiers d’évaluations d’actes professionnels par an entre 2018 et 2021.
- L’abattement de 20% pour les actes du stock de RIHN 1.0 prévu devrait s’appliquer au cours de l’année 2025 avec des conséquences réelles pour le financement des actes pour les utilisateurs de RIHN.
- Les délais du processus d’inscription à la nomenclature, dépendant des négociations entre Commission de Hiérarchisation des Actes de Biologie (CHAB) et l’UNCAM dans le contexte de l’accord conventionnel ne sont pas aujourd’hui connus. Ainsi la date d’inscription à la liste des actes et des prises en charge n’est pas estimable.
- Un des plus gros enjeu reste le financement des actes en sortie de RIHN pour les patients hospitalisés dans les établissements de santé publics.
Les programmes de recherches du Ministère
Il existe également des programmes de recherche financés par le Ministère qui permettent de financer l’innovation en biologie, parmi lesquels le PRT, PHRC, PRME, PREPS, PHRIP et ReSP-Ir. 18

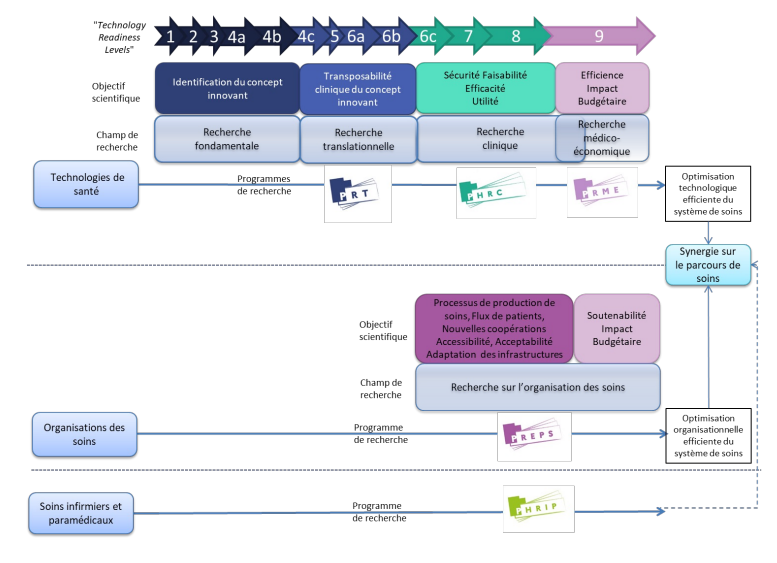
Le programme de recherche translationnelle (PRT) permet d’appliquer concrètement à la recherche clinique les découvertes issues de la recherche fondamentale.
Le programme hospitalier de recherche clinique (PHRC) pose depuis plus de 25 ans les jalons de la recherche appliquée en France. Son objectif est d’améliorer la santé humaine et le progrès des techniques de soins dans le respect de la personne.
Il existe 3 programmes autour de l’organisation de travail des équipes médicales, permettant l’accès à des innovations organisationnelles :
- Le programme de recherche médico-économique (PRME) a pour objet d’évaluer l’efficience – c’est-à-dire le rapport coût/qualité – des technologies de santé.
- Le programme de recherche sur la performance du système des soins (PREPS) évalue les organisations professionnelles améliorant la qualité des soins et des pratiques.
- Le programme hospitalier de recherche infirmière et paramédicale (PHRIP) accompagne depuis 10 ans les démarches innovantes qui favorisent l’amélioration des pratiques des auxiliaires médicaux et, ainsi, la qualité des soins délivrés aux patients.
- Il existe aussi les projet ReSP-Ir de recherche en soins primaires interrégional et Données de santé et ApplicaTions (DAtAE) concernant l’exploitation des entrepôts de données de santé hospitaliersLa sélection des projets de recherche dans le cadre des appels à projets du ministère est réalisée suivant un processus formalisé, dématérialisé et transparent grâce à la plateforme INNOVARC. 19.
En France, du multiples plans d’investissements sont disponibles pour stimuler l’innovation en santé20.
Le dernier en date France 2030 vise à accélérer la transformation des secteurs clés de l’ économie française par l’innovation et à positionner la France, non pas seulement en acteur, mais bien en « leader » du monde de demain21.
- SHC_SIDIV_LIVRE_BLANC / Comptes nationaux de la santé / DREES 2012 ↩︎
- Les dépenses de santé en 2022 – Résultats des comptes de la santé – Édition 2023 | Direction de la recherche, des études, de l’évaluation et des statistiques (solidarites-sante.gouv.fr) ↩︎
- https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000021708778 ↩︎
- Tarifs MCO et HAD | Publication ATIH (sante.fr) ↩︎
- Haute Autorité de Santé – Forfait innovation (has-sante.fr) ↩︎
- Expérimenter et innover pour mieux soigner – Ministère du travail, de la santé et des solidarités (sante.gouv.fr) ↩︎
- Le référentiel des actes innovants hors nomenclature de biologie et d’anatomopathologie (RIHN) – Ministère du travail, de la santé et des solidarités (sante.gouv.fr) ↩︎
- Les missions d’enseignement, de recherche, de référence et d’innovation – MERRI – Ministère de la santé et de l’accès aux soins (sante.gouv.fr) ↩︎
- https://www.legifrance.gouv.fr/download/pdf/circ?id=43288 ↩︎
- Bulletin officiel Santé – Protection sociale – Solidarité – Ministère de la santé et de l’accès aux soins ↩︎
- Idem note 7 ↩︎
- RIHN 2.0 : un soutien renouvelé à l’innovation pour les actes de biologie médicale et d’anatomopathologie – Ministère de la santé et de l’accès aux soins ↩︎
- https://sante.gouv.fr/IMG/pdf/ahn_presentation-travaux_v1-2_20240715_ri2.pdf ↩︎
- https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000049345711 ↩︎
- https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000046791754 ↩︎
- Idem note 8 ↩︎
- https://sante.gouv.fr/IMG/pdf/ahn_presentation-travaux_v1-2_20240715_ri2.pdf ↩︎
- Les programmes de recherche financés par le ministère et leurs appels à projets (sante.gouv.fr) et https://www.economie.gouv.fr/france-2030 ↩︎
- Idem note 8 ↩︎
- https://www.economie.gouv.fr/france-2030 ↩︎
- https://www.info.gouv.fr/grand-dossier/france-2030 ↩︎