L’approche syndromique au CHI de Villeneuve Saint-Georges
(Belkacem A, Diallo K, Raffetin A, Nguala S, Tchir M, Smati-Lafarge M, Leon R, Corlouer C, Caraux-Paz P)
Dr Kevin DIALLO, Service de Maladies Infectieuses et Tropicales.
Les pneumopathies sont des évènements fréquents. Lorsqu’elles sont graves, elles justifient l’introduction d’un traitement anti-infectieux empirique à large spectre et l’agent pathogène en cause est souvent inconnu.
La culture, le gold standard en matière du diagnostic microbiologique, requiert du temps long et peut être non contributive.
Dans ce contexte, il est intéressant de considérer une approche syndromique pour les prélèvements respiratoires bas qui détecte des agents pathogènes ciblés, même ceux difficiles à cultiver, et des gènes de résistance aux antibiotiques. « Cette approche nous permet d’adapter mieux l’antibiothérapie et de lutter contre l’antibiorésistance ».
« Sur notre GHT, nous avons acquis le BioFire® FilmArray® Pneumonia plus (PNplus) Panel en février 2019 et nous avons analysé les résultats de 2 CHG, Villeneuve Saint Georges et Créteil, qui sont annexés sur le même plateau technique. »
témoigne l’infectiologue Dr Diallo lors des Journées Nationales d’Infectiologie 2020
« Nous avons fait le choix de proposer ce panel aux patients hospitalisés en réanimation suspects de PAC sévères ou de PAVM. Pour d’autres patients hospitalisés hors Réanimation, Le BioFire® FilmArray® PNplus Panel a été réservé aux patients avec facteurs de risque d’immunodépression ou à ceux atteints de pneumopathies d’évolution défavorable ou récidivante. » résume le Dr Diallo.
résume le Dr Diallo
Caractéristiques du BioFire® FilmArray® Pneumonia plus Panel
Le BioFire® FilmArray® Pneumonia plus Panel identifie 27 agents pathogènes impliqués dans les infections respiratoires basses, ainsi que 7 marqueurs de résistance aux antibiotiques.
Pour 15 bactéries, le panel donne des résultats semi-quantitatifs, ce qui peut aider à différencier une infection d’un simple état de colonisation.
Bactéries du panel :
- Gram- : Haemophilus influenzae ; Moraxella catarrhalis ; Entérobactéries : Enterobacter cloacae complexe, Escherichia coli, Klebsiella aerogenes, Klebsiella oxytoca, Groupe Klebsiella pneumoniae, Proteus spp., Serratia marcescens ; Non-fermentants : Acinetobacter calcoaceticus-baumannii complexe, Pseudomonas aeruginosa.
- Gram+ : Streptococcus pneumoniae ; Streptococcus agalactiae ; Streptococcus pyogenes ; Staphylococcus aureus.
- Germes atypiques : Chlamydophila pneumoniae ; Mycopasma pneumoniae ; Legionella pneumophila.
Gènes de résistance aux antibiotiques du panel : Gènes codant pour β-lactamases à spectre élargi les plus prévalents : du type CTX-M ; Gènes codant pour les carbapénémases : OXA-48-like, IMP, KPC, NDM, VIM ;mecA/C qui confère la résistance la méthicilline et la jonction MREJ reliant ce gène au Staphylocoque doré.
Virus du panel : Adénovirus ; Coronavirus ; Entérovirus/rhinovirus humains ; Métapneumovirus humain ; Virus de la grippe A ; Virus de la grippe B ; Coronavirus du syndrome respiratoire du Moyen-Orient (MERS-CoV) ; Virus parainfluenza ; Virus respiratoire syncytial.
Echantillons requis (Marqués CE-IVD, approuvés FDA) : expectoration (Aspiration endo trachéale (AET) compris) ou Lavage broncho-alvéolaire (LBA) (mini-LBA compris).
Délai : temps de manipulation 2 minutes. Analyse de 75 min.
« Nous avons étudié de manière rétrospective sur une année d’expérience avant la pandémie SARS-CoV-2 (de Février 2019 au Janvier 2020) tous les dossiers patients qui ont bénéficié du BioFire PNplus Panel sur LBA ou AET, en association avec la culture. »
explique le docteur Diallo
L’objectif de cette étude était d’évaluer l’impact de l’utilisation du BioFire® FilmArray® PNplus Panel dans le diagnostic de pneumopathie sur la consommation d’antibiotiques.
L’objectif secondaire était d’évaluer la concordance entre le BioFire® FilmArray® PNplus Panel et la culture conventionnelle.
Pour les cas discordants BioFire positif/culture négative, deux infectiologues ont évalué de façon indépendante une corrélation clinique pour déterminer la significativité de la PCR.
Au total, 56 cas de pneumopathies suspectées ont été inclus. Les patients séjournaient en réanimation (44), médecine infectieuse (10), médecine polyvalente (1) et pneumologie (1).
Le BioFire® FilmArray® PNplus Panel a permis de faire un diagnostic microbiologique dans 69.6% (39/56), alors que la rentabilité diagnostique de la culture était de 21,4% (12/56) (Tableau 1).
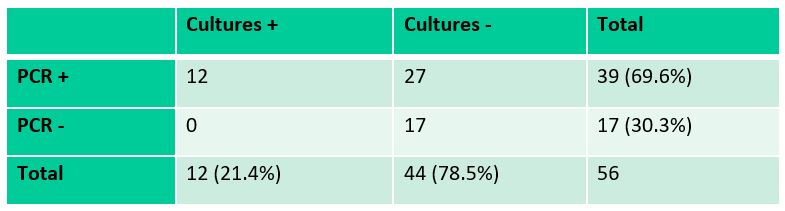
La concordance entre le BioFire® FilmArray® PNplus Panel (PCR) et la culture pour la détection des bactéries est illustrée dans la figure 1.
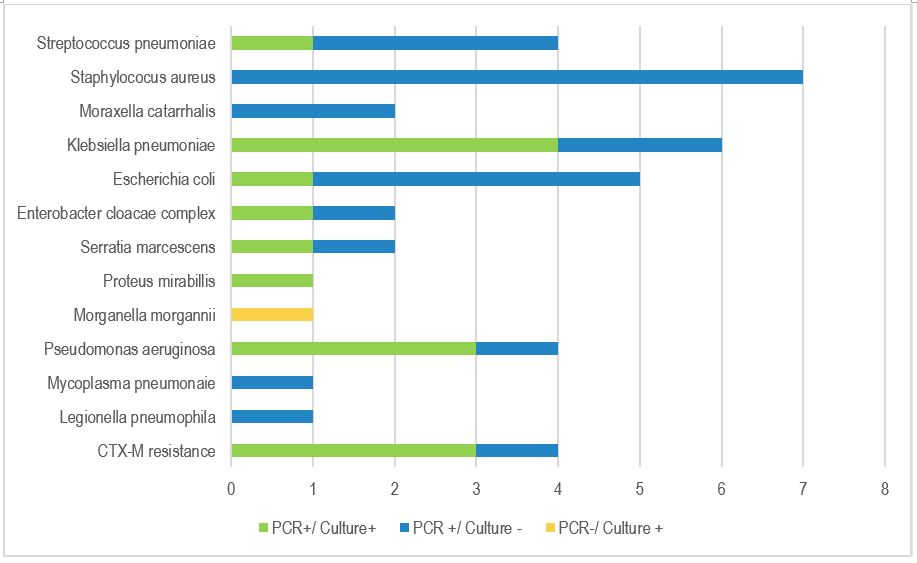
Pour les discordants PCR+/culture -, dans 8 cas l’antibiothérapie préalable constatée avait pu décapiter les prélèvements microbiologiques, dans 2 cas les cultures étaient inférieures au seuil, dans 2 cas la PCR a détecté des bactéries atypiques.
Les pathogènes les plus fréquents, mis en évidence par le BioFire® FilmArray® PNplus Panel étaient les entérobactéries, H. influenzae, S. aureus et le virus de la grippe A.
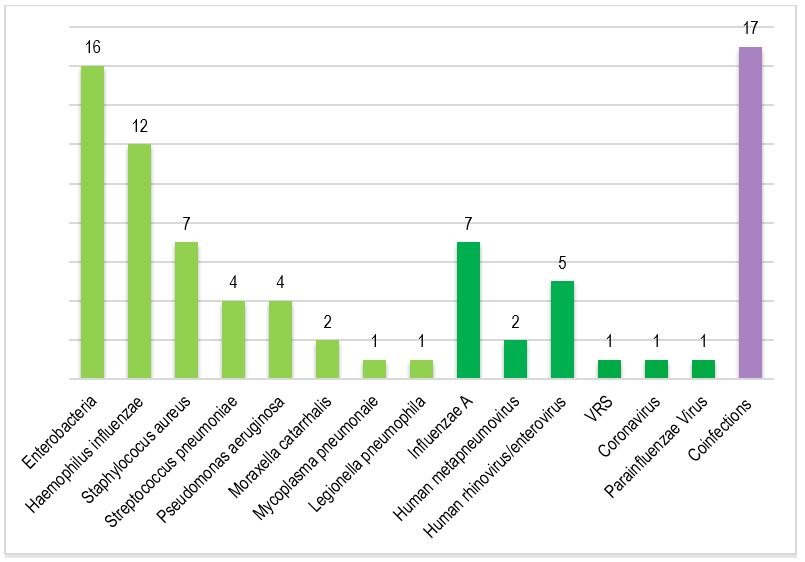
17 coïnfections ont été observées : 1 virale, 9 bactériennes, 7 mixtes (bactéries-virus).
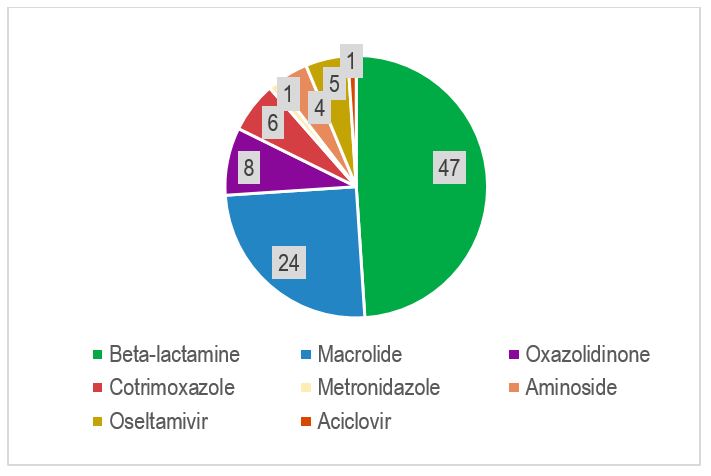
Au moment de la PCR multiplex, 50 patients sur 56 ont reçu au total 97 traitements anti-infectieux empiriques (Figure 3). Les Beta-lactamines à large spectre ont été majoritairement utilisées et en 2ème intention des macrolides dans un quart de cas.
Quel a été l’impact du BioFire® FilmArray® PNplus panel ?
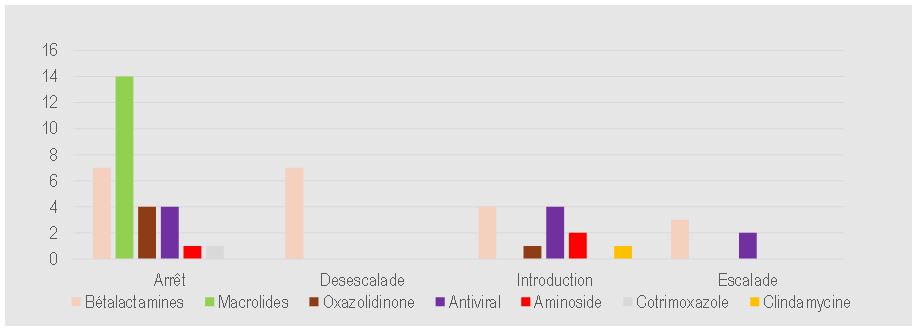
Sur les 97 traitements anti-infectieux prescrits chez 50 patients, les résultats du BioFire® FilmArray® PNplus Panel ont conduit à une adaptation rapide de 54 traitements : arrêt (30 ; 30,9%) chez 24 patients, introduction ou élargissement du spectre (17 ; 17,5%) chez 17 patients, désescalade (7 ; 7,2%) chez 7 patients (Figure 4), aucune action (33 ; 34%) chez 19 patients.
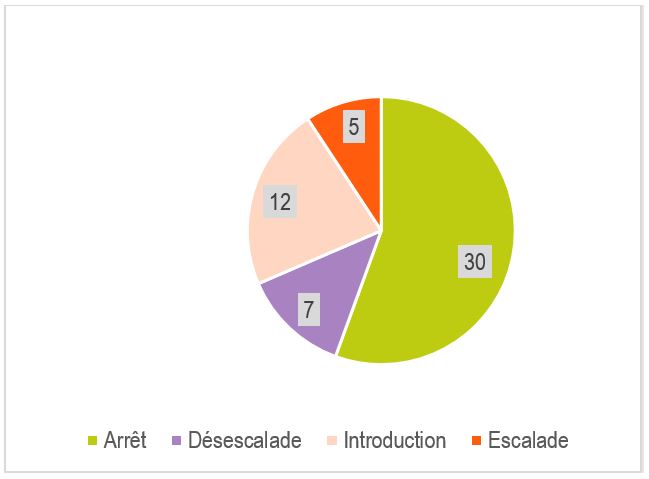
L’impact immédiat le plus fort constaté dans cette étude était l’arrêt des macrolides, suivi de l’arrêt ou désescalade des beta-lactamines.
Dans 17 cas où PCR et cultures étaient négatives, les diagnostics différentiels étaient : pneumopathies non documentés (7), pneumocystose (2), abcès pulmonaire (1), œdème aigu pulmonaire (3), poussée de fibrose (1), syndrome thoracique aigu (1), toxicité médicamenteuse (2).
« Nous avons observé une meilleure sensibilité de la PCR multiplex BioFire® par rapport à la culture, notamment dans les cas d’exposition préalable aux antibiotiques. Le BioFire® FilmArray® PNplus Panel nous a permis de gagner du temps pour adapter un traitement anti-infectieux de manière précoce. Nous avons pu épargner des antibiotiques ou des antiviraux, résultant en un meilleur impact écologique. De plus, le BioFire® FilmArray® PNplus Panel a mis en évidence des co-infections mixtes virus/bactéries, qui peuvent être associées à des complications conduisant à une ventilation mécanique de >7 jours ou à une mortalité plus élevée (Voiriot et al, Critical Care 2016; Loubet et al, Journal of Clinical Virology 2017). Pour le rendu des résultats, il faut garder à l’esprit que certains pathogènes ne sont pas inclus dans le panel (ex. Pneumocystis jiroveci, Mycobactéries, Stenotrophomonas maltophilia, Hafnia alvei, Morganella morgannii). Pour rendre des résultats cliniquement significatifs, nous recommandons une interprétation par un spécialiste en infectiologie pour différencier infection et colonisation lors d’un germe retrouvé par PCR multiplex. »
conclut le Dr Diallo